این مقاله ممکن است برای مطابقت با استانداردهای کیفی ویکیپدیا نیازمند بازنویسی باشد. (ژوئیه ۲۰۲۴) |
| استافیلوکوک اورئوس | |
|---|---|

| |
| ردهبندی علمی | |
| حوزه: | باکتریها |
| فرمانرو: | یوباکتریا |
| شاخه: | فیرمیکوتها |
| رده: | کوکسیها |
| راسته: | باسیلالس |
| تیره: | استافیلوکوکاسیه |
| سرده: | استافیلوکوک |
| گونه: | استافیلوکوک اورئوس |
| نام دوبخشی | |
| Staphylococcus aureus Rosenbach 1884
| |
استافیلوکوک اورئوس (به لاتین: Staphylococcus aureus)، کوکسی گرم مثبت و بیهوازی اختیاری است که مهمترین گونه در جنس (سرده) استافیلوکوک از نظر پزشکی محسوب میشود. گاهی به این باکتری، استافیلوکوک طلایی نیز میگویند. اورئوس در زبان لاتین به معنای طلایی است.[۱]
این باکتری ممکن است به شکل فلور عادی پوست یا بینی وجود داشته باشد. اینطور تخمین زده میشود که ۲۰ درصد از مردم به مدت طولانی، ناقل باکتری باشند. استافیلوکوک اورئوس، یکی از موفقترین باکتریهای بیماریزاست. این باکتری به دلیل تولید رنگدانه طلایی کارتنوئیدی به نام استافیلوزانتین(به لاتین: staphyloxanthin)، کلنیهای زرد رنگی را ایجاد مینماید. این پیگمان در بیماریزایی نقش دارد زیرا به عنوان ماده آنتیاکسیدان عمل کرده و موجب در امان ماندن باکتری در برابر رادیکالهای آزاد اکسیژن میشود.[۲] رادیکالهای آزاد اکسیژن توسط سیستم ایمنی (گلبولهای سفید) میزبان برای کشتن باکتریها تولید میشوند.
استافیلوکوک اورئوس، گستره وسیعی از عفونتها از عفونتهای ساده پوستی (مانند جوشدانه، کورک، کفگیرک، گل مژه و آبسه) گرفته تا بیماریهای تهدیدکننده زندگی (مانند پنومونی، مننژیت، استئومیلیت، اندوکاردیت، سندرم شوک سمی و سپتی سمی) را ایجاد مینماید. استافیلوکوک اورئوس به عنوان یکی از ۵ عامل شایع ایجادکننده عفونتهای بیمارستانی به ویژه عفونتهای زخم پس از جراحی است. هر سال، ۵۰۰ هزار نفر در بیمارستانهای ایالات متحده آمریکا به عفونتهای استافیلوکوک اورئوس مبتلا میشوند.[۳]
استافیلوکوک اورئوس مقاوم به متی سیلین (MRSA)، سویههای خاصی از این باکتری هستند که به بیشتر آنتیبیوتیکها مقاوم میباشند. MRSA، بیشتر در بیمارستانها دیده شده است. به این نوع از سویهها، HA-MRSA یا به اصطلاح، استافیلوکوک اورئوس مقاوم به متی سیلین اکتسابی از بیمارستان میگویند اما در حال حاضر، سویههای استافیلوکوک اورئوس مقاوم به متی سیلین اکتسابی از جامعه (CA-MRSA) در حال گسترش میباشند. سویههای CA-MRSA بر خلاف HA-MRSA، ارتباطی با بستری شدن در بیمارستان ندارند. استافیلوکوک اورئوس اولین بار در سال ۱۸۸۰ توسط جراح اسکاتلندی، آلکساندر اوگستون(به انگلیسی: Alexander Ogston) در شهر آبردین (اسکاتلند) از نمونه چرک آبسه جراحی جدا شد.[۴]
میکروبشناسی
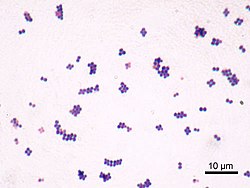

استافیلوکوک اورئوس، کوکسی گرم مثبت و بیهوازی اختیاری است که به شکل خوشه در زیر میکروسکوپ دیده میشود. کلنی باکتری، به شکل زرد طلایی است و هنگامیکه بر روی محیط آگار خوندار رشد میکند، ایجاد همولیز مینماید.[۵]
این باکتری، آنزیم کاتالاز را تولید میکند. آنزیم کاتالاز موجب تجزیه پراکسید هیدروژن (H2O2)به آب و اکسیژن میشود. تست کاتالاز برای تمایز استرپ از استاف هم قابل استفاده است.
این تست برای تمایز استافیلوکوکها از استرپتوکوکها و انتروکوکها استفاده میشود. استافیلوکوک اورئوس، آنزیم کواگولاز را تولید میکند. آین آنزیم، خون را لخته میکند. سایر گونههای استافیلوکوک از نظر کواگولاز منفی هستند اما استثنا استافیلوکوکهای دلفینی و شلیفری و هلیکوس و اینترمدیوس هم دارای کواگولاز مثبت هم است.[۵]
نقش در بیماری
استافیلوکوک اورئوس با تولید انتروتوکسین، ایجاد مسمومیت غذایی میکند. باکتری ممکن است به شکل همزیست بر روی پوست وجود داشته باشد و از بینی یک سوم از مردم جدا شود.[۶] این باکتری به میزان کمتر ممکن است در گلو نیز وجود داشته باشد. وجود استافیلوکوک اورئوس در این شرایط به معنای عفونت نیست و نیازی هم به درمان در اینگونه موارد نمیباشد. باکتری ممکن است در حیوانات اهلی، گربهها، سگها و اسبها وجود داشته باشد و موجب التهاب و عفونت پا در مرغها شود. استافیلوکوک اورئوس ممکن است بر روی سطوح خشک برای هفتهها تا ماهها زنده بماند.[۷] برخی از فاژها (باکتریوفاژها) میتوانند استافیلوکوک اورئوس را آلوده کنند و از این طریق موجب انتقال ژن تولیدکننده توکسین پنتون- والنتین به آن شوند. از این رو، بیماریزایی سویهها را افزایش خواهند داد.
هنگامی که سد پوستی از بین برود، باکتری به بافت حمله میکند و بیماریهایی مانند کورک و کفگیرک را ایجاد میکند. استافیلوکوک اورئوس در کودکان، عفونت شدید به نام سندرم پوستی فلسی شونده استافیلوکوکی(به انگلیسی: staphylococcal scalded skin syndrome) را ایجاد میکند.[۸]
عفونتهای استافیلوکوکی از طریق تماس با چرک زخم یا پوست با پوست انتقال پیدا میکنند. تماس با وسایل شخصی مانند حوله، ملحفه، لباس و وسایل ورزشی نیز در انتقال عفونت از فردی به فرد دیگر نقش دارند. عفونتهای عمیق ممکن است شدید باشند مانند آرتریت سپتیک، اندوکاردیت و پنومونی.
درماتیت آتوپیک
این باکتری یکی از عوامل درماتیت آتوپیک است. جوشدانهها بیشتر در زیر بغل، فرق سر و موها دیده میشوند. این حالت ممکن است به صورت سندرم پوستی فلسی شونده درآید. حالت بسیار شدیدتر به نام سندرم ریتر (به انگلیسی: Ritter's disease) یا پمفیگوس نئوناتوروم (به لاتین: Pemphigus neonatorum) در نوزادان دیده شده است.
سندرم شوک سمی
سویههایی که اگزوتوکسین TSST-1 را تولید میکنند ممکن است موجب بیماری بالقوه مهلک و کشندهای به نام سندرم شوک سمی (به انگلیسی: Toxic shock syndrome) شوند. استرپتوکوک پیوژنز نیز ممکن است سندرم مشابهای به نام سندرم شوک سمی استرپتوکوکی را ایجاد کند. علائم بیماری شامل تب بالا، کاهش فشار خون، ناخوشی، گیجی و در نهایت از کار افتادن اندامهای داخلی بدن انسان، کما و مرگ است. راشهای شبیه آفتاب سوختگی در مراحل اولیه بیماری در لب، چشم، دهان، کف دست و پا دیده میشوند. در صورت درمان، بیمار پس از چند هفته، سلامتی خود را بازمییابد در غیر این صورت، در عرض چند ساعت خواهد مرد. این سندرم به میزان ۳ تا ۴ مورد از هر ۱۰۰ هزار زنی که از تامپونهای واژنی در زمان قاعدگی استفاده میکنند، دیده شده است. در صورت راهیابی باکتری به واژن، در حضور تامپون در آنجا تکثیر پیدا کرده و توکسین TSST-1 را تولید میکند. توکسین از آنجا وارد خون میشود و در سرتاسر بدن پخش خواهد شد. این آمار مربوط به امریکاست. سندرم شوک سمی غیر از این موارد مثلاً" ناشی از عفونتهای زخم بسیار نادر است.[۹]
مسمومیت غذایی
استافیلوکوک اورئوس با تولید انتروتوکسین در غذا موجب گاستروانتریت و مسمومیت غذایی میشود. مسمومیت غذایی خود محدود شونده است و به درمان خاصی نیاز ندارد. بیمار پس از ۸ تا ۲۴ ساعت بهبود پیدا میکند. علائم مسمویت غذایی شامل اسهال، استفراغ و درد شکمی است.
ورم پستان در گاو
استافیلوکوک اورئوس موجب ماستیت (وروم پستان) در گاو میشود. کپسول پلی ساکاریدی آن، موجب عدم شناسایی باکتری توسط سیستم ایمنی گاو میشود.[۱۰]
فاکتورهای بیماریزایی
آنزیمها
باکتری، آنزیمهای مختلفی را تولید میکند. کواگولاز موجب لخته شدن خون و در نتیجه عدم فاگوسیت شدن توسط گلبولهای سفید میشود. هیالورونیداز، اسید هیالورونیک موجود در بافت همبند را تجزیه کرده و موجب گسترش باکتری در بدن میشود. استافیلوکوک اورئوس، آنزیم دزوکسی ریبونوکلئاز (DNAse) را تولید میکند که DNA را تجزیه میکند.
توکسینها
باکتری توکسینهای مختلفی را تولید میکند که هریک بیماریهای خاصی را ایجاد میکند. توکسین TSST-1 در ایجاد سندرم شوک سمی نقش دارد. انتروتوکسینها در مسمومیت غذایی نقش دارند. TSST-1 و انتروتوکسینها، سوپرآنتی ژن هستند. توکسین فلسیکننده (به انگلیسی: Exfoliative toxin)موجب سندرم پوستی فلسی شونده استافیلوکوکی میشود. این توکسین نوعی پروتئاز است که پوست را تجزیه میکند.
استافیلوکوک اورئوس، توکسینهای دیگری مانند توکسین آلفا، توکسین بتا و توکسین گاما را تولید میکند که موجب تجزیه غشای بسیاری از سلولهای بدن میشود. توکسین پنتون- والنتین، پنومونی نکروز دهنده شدید در کودکان ایجاد مینماید. ژن توکسین اخیر بر روی باکتریوفاژ قرار دارد که از طریق آلوده شدن باکتری به فاژ، به آن انتقال پیدا میکند. توکسین پنتون- والنتین، بیشتر در سویههای MRSA اکتسابی از جامعه (CA-MRSA) دیده شده است.
پروتئین A
پروتئین A از طریق آنزیم ترانسپپتیدازی به نام سورتاز به پپتیدوگلیکان (دیواره سلولی باکتریایی) متصل میشود. پروتئین A به قسمت Fc از آنتیبادی IgG(به جز igg3) متصل میشود. جهش در ژن پروتئین اخیر موجب کاهش بیماریزایی باکتری میشود.[۱۱] از پروتئین A در تخلیص گستره وسیعی از آنتیبادیها در کروماتوگرافی استفاده شده است.
پیگمان
این باکتری به دلیل تولید رنگدانه طلایی کارتنوئیدی به نام استافیلوزانتین(به لاتین: staphyloxanthin)، کلنیهای زرد رنگی را ایجاد مینماید. این پیگمان در بیماریزایی نقش دارد زیرا به عنوان ماده آنتیاکسیدان عمل کرده و موجب در امان ماندن باکتری در برابر رادیکالهای آزاد اکسیژن میشود.[۲]
تشخیص آزمایشگاهی

رنگ آمیزی گرم، باکتری را به شکل کوکسیهای خوشهای گرم مثبت نشان میدهد. از محیط اختصاصی مانیتول نمکی (۷ تا ۹ درصد نمک) برای رشد استافیلوکوک اورئوس استفاده میشود. این باکتری، نمک را تحمل کرده و پس از رشد بر روی محیط اخیر، کلنیهای زرد رنگی تولید میکند که به دلیل تخمیر مانیتول و کاهش pH محیط کشت ایجاد میشود.
تمامی گونههای استافیلوکوک از نظر تست کاتالاز مثبت هستند. استافیلوکوک اورئوس از نظر تست کواگولاز (ایجاد لخته خون) مثبت است. باکتری، آنزیم DNAse را تولید میکند. از نظر تست لیپاز و فسفاتاز هم مثبت است.
درمان و مقاومت آنتیبیوتیکی
پس از کشف پنی سیلین، در ابتدا از این دارو برای درمان عفونتهای استافیلوکوکی استفاده میشد اما روز به روز به مقاومت آنتیبیوتیکی علیه پنی سیلین افزوده شد بطوریکه در سال ۱۹۵۰، ۴۰ درصد سویههای بیمارستانی به پنی سیلین مقاوم شدند و این میزان در سال ۱۹۶۰ به ۸۰ درصد رسید. علت این دیده تولید پنی سیلیناز توسط باکتری بود که پنی سیلین را تجزیه میکند؛ بنابراین از آنتیبیوتیکهای جدیدتر یعنی پنی سیلینهای مقاوم به پنی سیلیناز (مانند اکساسیلین و متی سیلین) استفاده شد.[۱۲] متأسفانه این باکتری به مرور به این آنتیبیوتیکها نیز مقاوم شده است. از این آنتی بیوتکها به همراه جنتامایسین برای درمان عفونتهای جدی مانند اندوکاردیت استفاده میشود.
مقاومت به متی سیلین و سایر پنی سیلینهای مقاوم به پنی سیلیناز به دلیل اپرون mec است. این اپرون، بخشی از کاست کروموزومی استافیلوکوکی (SCCmec) است. ژن mecA، پروتئین متصل شونده به پنی سیلین با نام PBP2a را کد میکند که میل پیوندی پایینی برای آنتیبیوتیکهای بتالاکتام دارد. لازم است بدانید که پروتئینهای PBP در ساخت و ساز دیواره سلولی باکتریایی نقش دارند. از این رو، وجود چنین پروتئین جدیدی تحت تأثیر آنتیبیوتیک نخواهد بود و باکتری به راحتی به زندگی خود ادامه میدهد. این سویهها در اصطلاح استافیلوکوکهای مقاوم به متی سیلین (MRSA) میگویند. برای درمان MRSA، از آنتیبیوتیک دیگری به نام وانکومایسین استفاده میشود. همچنین از آنتیبیوتیک جدیدی به نام لینزولید نیز برای درمان MRSA استفاده شده است.
آنتیبیوتیکهای آمینوگلوکوزیدی مانند جنتامایسین، استرپتومایسین و کانامایسین زمانی به خوبی علیه استافیلوکوکها جواب میدادند اما استافیلوکوک به مرور زمان به این آنتیبیوتیکها نیز مقاوم شد. این آنتیبیوتیکها با اتصال به زیر واحد ۳۰S ریبوزومی منجر به مرگ باکتری میشوند.[۱۳] مقاومت به آمینوگلوکوزیدها در استافیلوکوکها به سه شکل دیده شده است: آنزیمهای تغییر دهنده آمینوگلوکوزیدها (موجب تغییر ساختار آنتیبیوتیک و غیرفعال سازی آن میشود)، جهشها یا موتاسیونهای ریبوزومی (موجب تغییر در جایگاه هدف اتصال آنتیبیوتیک خواهند شد؛ بنابراین، آنتیبیوتیک دیگر نمیتواند به هدف خود متصل شود)، پمپهای افلاکس در غشای باکتری که بهطور فعالانه آنتیبیوتیک را از داخل باکتری به خارج از آن، پمپ میکنند. مقاومت به وانکومایسین (و سایر آنتیبیوتیکهای گلیکوپپتیدی) بر اثر ژن vanA ایجاد میشود. این ژن از انتروکوک به استافیلوکوک انتقال یافته است. این ژن طوری پپتیدوگلیکان را تغییر میدهد که وانکومایسین دیگر نتواند به آن متصل شود. به این سویهها، استافیلوکوکهای مقاوم به وانکومایسین (VRSA) میگویند. سویههای دیگری نیز گزارش شدهاند که بهطور میانه به وانکومایسین مقاوم (VISA)هستند. سویههای اخیر اولین بار در سال ۱۹۹۶ از ژاپن گزارش شدند و در درمان آنتیبیوتیکهای مقاوم به ونکومایسین از سفالوسپیرینهای نسل پنجم مثل سفتازولین استفاده میشود.nb.[۱۴]
جستارهای وابسته
منابع
- ↑ Kluytmans J, van Belkum A, Verbrugh H (July 1997). "Nasal carriage of Staphylococcus aureus: epidemiology, underlying mechanisms, and associated risks". Clin. Microbiol. Rev. 10 (3): 505–20. PMC 172932. PMID 9227864.
- ↑ ۲٫۰ ۲٫۱ Clauditz A, Resch A, Wieland KP, Peschel A, Götz F (August 2006). "Staphyloxanthin plays a role in the fitness of Staphylococcus aureus and its ability to cope with oxidative stress". Infection and immunity 74 (8): 4950–3. doi:10.1128/IAI.00204-06. PMC 1539600. PMID 16861688.
- ↑ Bowersox, John (27 May 1999). "Experimental Staph Vaccine Broadly Protective in Animal Studies". NIH. Archived from the original on 5 May 2007. Retrieved 28 July 2007.
- ↑ Ogston A (1984). ""On Abscesses". Classics in Infectious Diseases". Rev Infect Dis 6 (1): 122–28. PMID 6369479.
- ↑ ۵٫۰ ۵٫۱ Ryan KJ, Ray CG (editors) (2004). Sherris Medical Microbiology (4th ed.). McGraw Hill. ISBN 0-8385-8529-9.
- ↑ Whitt, Dixie D. ; Salyers, Abigail A. (2002) [2002]. "14". Bacterial Pathogenesis: A Molecular Approach (2nd ed.). USA: ASM Press. ISBN 1-55581-171-X.
- ↑ Cimolai. MRSA and the environment: implications for comprehensive control measures. European journal of clinical microbiology & infectious diseases: official publication of the European Society of Clinical Microbiology (2008) vol. 27 (7) pp. 481-93
- ↑ Curran JP, Al-Salihi FL (1980). "Neonatal staphylococcal scalded skin syndrome: massive outbreak due to an unusual phage type". Pediatrics 66 (2): 285–90. PMID 6447271.
- ↑ ulie Sevrens Lyons/Knight Ridder Newspapers, "A New Generation Faces Toxic Shock Syndrome," The Seattle Times, January 25, 2005, http://seattletimes.nwsource.com/html/health/2002160362_healthtoxicshock26.html, accessed April 8, 2009, first published as "Lingering Risk," San Jose Mercury News, December 13, 2004
- ↑ Cenci-Goga BT, Karama M, Rossitto PV, Morgante RA, Cullor JS (September 2003). "Enterotoxin production by Staphylococcus aureus isolated from mastitic cows". Journal of food protection 66 (9): 1693–6. PMID 14503727.
- ↑ Patel AH, Nowlan P, Weavers ED, Foster T (December 1987). "Virulence of protein A-deficient and alpha-toxin-deficient mutants of Staphylococcus aureus isolated by allele replacement". Infect. Immun. 55 (12): 3103–10. PMC 260034. PMID 3679545.
- ↑ Chambers HF (2001). "The changing epidemiology of Staphylococcus aureus?". Emerg Infect Dis 7 (2): 178–82. doi:10.3201/eid0702.010204. PMC 2631711. PMID 11294701.
- ↑ Carter AP, Clemons WM, Brodersen DE, Morgan-Warren RJ, Wimberly BT, Ramakrishnan V (September 2000). "Functional insights from the structure of the 30S ribosomal subunit and its interactions with antibiotics". Nature 407 (6802): 340–8. doi:10.1038/35030019. PMID 11014183.
- ↑ Hiramatsu K, Hanaki H, Ino T, Yabuta K, Oguri T, Tenover FC (1997). "Methicillin-resistant Staphylococcus aureus clinical strain with reduced vancomycin susceptibility". J Antimicrob Chemother 40 (1): 135–6. doi:10.1093/jac/40.1.135. PMID 9249217.








